はじめに
SGLT2阻害薬は、ここ10年で最も注目を集めた薬剤クラスの一つです。
当初は「尿に糖を捨てる」という単純な糖尿病治療薬として登場しましたが、今では心不全・慢性腎臓病の治療薬として、糖尿病の有無を問わず幅広く使用されています。
本記事では、SGLT2阻害薬の代表格であるダパグリフロジン(フォシーガ®)を軸に、SGLT2阻害のメカニズムから臓器保護作用まで、できるだけわかりやすく、かつ深くまとめました。
薬学生にも現場の薬剤師にも役立つよう、単なる知識の羅列ではなく、「なぜこの薬がこれほど注目されているのか」を理解できる記事を目指しました。
まずは、ダパグリフロジンの基本的な知識を再確認しておきましょう。
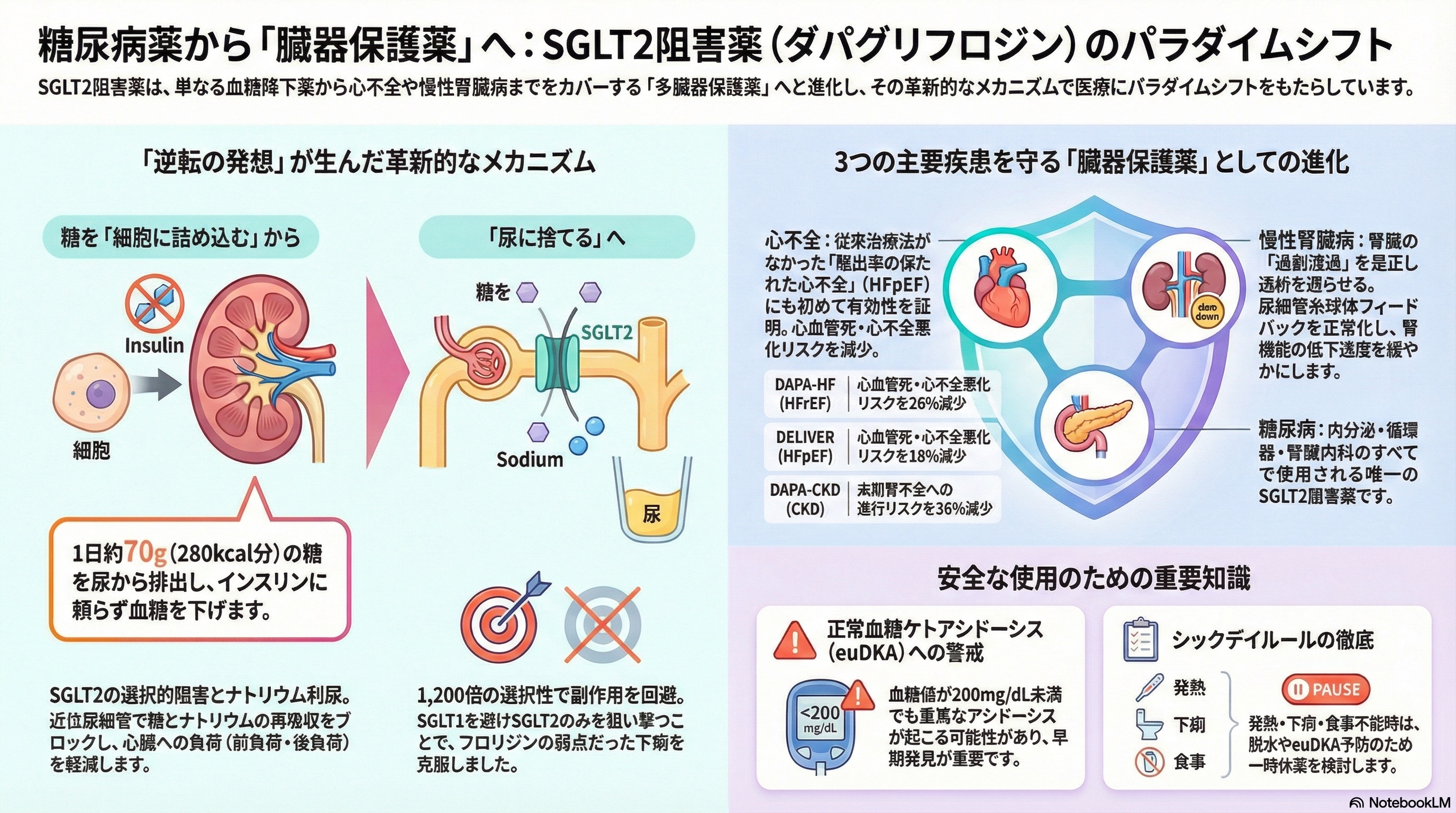
3分でわかるダパグリフロジン
商品名:フォシーガ®
一般名:ダパグリフロジンプロピレングリコール水和物
薬効分類:SGLT2阻害薬(ナトリウム・グルコース共輸送体2阻害薬)
主な適応症
2型糖尿病
慢性心不全(HFrEF・HFpEF)
慢性腎臓病(糖尿病の有無を問わない)
開発の経緯
2012年欧州、2014年日本承認の世界初SGLT2阻害薬。
フロリジン(リンゴの樹皮成分)から着想を得て開発。アストラゼネカ社が1,200倍のSGLT2選択性を達成し、「糖を尿に捨てる」という逆転の発想で糖尿病治療に新たな選択肢をもたらしました。
「糖尿病」という病名は糖が尿に出る病気を意味しますが、あえて積極的に糖を尿に出すという逆説的なアプローチが特徴です。
作用機序
腎臓で糖の再吸収を阻害し、尿に糖を排出する薬です。
SGLT2阻害で糖再吸収を阻止
1日約70gの糖を尿中に排出
インスリン非依存的に血糖低下
ナトリウムも同時に排出(ナトリウム利尿)することで心腎保護作用も発揮
臨床での位置づけ
糖尿病薬から臓器保護薬へ進化した、最も幅広い適応を持つSGLT2阻害薬です。
2型糖尿病(2014年)→心不全(2019年HFrEF、2022年HFpEF)→慢性腎臓病(2021年)と適応拡大。内分泌科・循環器科・腎臓内科すべてで使用される唯一の薬剤です。
それでは、本題に入っていきましょう。
ダパグリフロジンの作用機序
1. 主作用:SGLT2の選択的阻害
ダパグリフロジンは腎臓の近位尿細管でナトリウム・グルコース共輸送体2(SGLT2)を選択的に阻害します。
SGLT2は1個のグルコースと2個のナトリウムを一緒に運ぶポンプで、これを阻害することで糖とナトリウムの両方が尿中に排出されます。
正常では99%再吸収される糖の再吸収を30-50%まで低下させます。
なぜ「糖を捨てる」発想が注目されるのか
従来の糖尿病薬はすべて「糖を細胞に取り込ませる」発想でした。
SGLT2阻害薬は逆転の発想で「あえて積極的に糖を尿に排出」することで、インスリン非依存的に血糖を下げる全く新しいアプローチです。
2. グルコース排泄による効果
1日約70g(280kcal)の糖を尿中に排出します。これにより以下の効果が得られます:
血糖値の低下:HbA1c 0.5-1.0%低下
体重減少効果:平均2-3kgの体重減少
低血糖リスクが低い:インスリン非依存的なため単独使用での低血糖リスクは1%未満
3. 心腎保護作用のメカニズム
ダパグリフロジンは単なる血糖降下薬を超えて、臓器保護薬として進化しました。主な心腎保護作用は以下の通りです:
ナトリウム利尿:ナトリウムも同時に排出され、心臓の前負荷が軽減
ケトン体産生:心筋のエネルギー効率が改善
糸球体内圧低下:尿細管糸球体フィードバック機構により腎保護
抗炎症・抗線維化作用:臓器の構造的変化を抑制
4. インスリン非依存的作用の意義
膵β細胞機能に関係なく効果を発揮するため、糖尿病の病期を問わず使用可能です。
インスリン分泌を刺激しない
インスリン感受性に依存しない
膵β細胞への負担がない
腎臓での糖再吸収:なぜ99%も回収するのか
ダパグリフロジンの働きを理解するには、まず腎臓が正常時になぜ必死に糖を再吸収するのかを知る必要があります。
1日180gの糖を失わないために
健常人の腎臓では、血液中のグルコースが1日に約180g糸球体でろ過されます。
これは角砂糖45個分(1個4g換算)、ご飯茶碗4杯分のカロリー(720kcal)に相当する膨大な量です。もしこの糖をそのまま尿として失えば、生命維持は不可能でしょう。
脳だけでも1日120gの糖を消費する大食漢であり、糖の喪失は生命活動に直結します。
人類の歴史の99%は飢餓との戦いであり、腎臓は糖を一滴も漏らさないという生存戦略を進化させてきました。
さらに、尿糖は浸透圧の関係で水分を引き連れて排泄されるため脱水のリスクがあり、細菌の餌となって尿路感染症の原因にもなります。
これらの理由から、腎臓は99%以上という驚異的な再吸収率を維持しているのです。
腎臓が糖を完全回収する3つの理由
エネルギー保存:脳は1日120g消費、糖の喪失は致命的(720kcal/日の損失)
浸透圧維持:尿糖は水分を引き連れて排泄→脱水リスク
感染防御:尿糖は細菌の餌→尿路感染症のリスク
健常人vs糖尿病患者
健常人と糖尿病患者では、腎臓での糖の処理に大きな違いがあります。
健常人では血糖値が正常範囲にあるため、濾過された糖はすべて再吸収され、尿糖は検出されません。
しかし、糖尿病患者では血糖値が高いため濾過される糖の量が増え、腎臓の再吸収能力を超えてしまいます。
腎臓の再吸収限界
SGLT1とSGLT2の輸送能力には物理的限界(1日約220g)があり、これを超えると尿糖が出現します。
通常は血糖値180mg/dL(腎閾値)を超えると尿糖が出始めます。
SGLT2阻害薬はこの閾値を人工的に50-80mg/dLまで下げることで、積極的に糖を排泄させます。
この「糖を捨てる」という発想は、1835年のフロリジン発見から150年以上実用化が困難とされていました。
しかし、SGLT2阻害薬は従来の「インスリンを増やして血糖を下げる」から「糖を捨ててインスリンの必要量を減らす」というパラダイムシフトを実現し、膵β細胞の保護と低血糖リスクの低減を達成しました。
SGLTファミリーの役割分担
腎臓にはSGLT1とSGLT2(Sodium-Glucose co-transporter:ナトリウム・グルコース共輸送体)という2つの糖輸送体が存在し、巧妙な連携によって糖の再吸収を行っています。
SGLT2が大量処理を担当し、SGLT1が取りこぼしを防ぐという二段構えのシステムで、99%以上という驚異的な再吸収率を実現しているのです。
SGLT2(近位尿細管S1セグメント)
濾過されたグルコースの90%を再吸収
低親和性・高容量型(大量処理に特化)
1個のグルコースと2個のナトリウムを共輸送
SGLT1(近位尿細管S3セグメント)
SGLT2が取り逃した残り10%を回収
高親和性・低容量型(完璧な回収に特化)
小腸での糖吸収にも必須(だから阻害できない)
→ 二段構えのシステムで99%以上の再吸収を実現
なぜSGLT2だけを阻害するのか?
SGLT1は小腸での糖吸収に必須であり、これを阻害すると重度の下痢を引き起こします。そのため、SGLT2阻害薬はSGLT2に対して1,000倍以上の選択性を持つよう設計されています。
ダパグリフロジンは1,200倍という業界でも上位レベルの選択性を実現しました。
SGLT2阻害の多面的効果
SGLT2阻害薬は単なる血糖降下薬ではありません。糖と一緒にナトリウムも排泄されることで、心腎保護効果が生まれることが判明しました。
この「ナトリウム利尿」こそが、SGLT2阻害薬を臓器保護薬へと変えた鍵です。
なぜナトリウムも排出されるのか
SGLT2(Sodium-Glucose co-transporter 2)は「ナトリウム・グルコース共輸送体2」という名前が示すとおり、ナトリウムとグルコースをセットで運ぶポンプです。
このポンプは腎臓の近位尿細管に存在し、尿から糖とナトリウムを回収する役割を担っています。
SGLT2阻害薬がこのポンプをブロックすると、糖だけでなくナトリウムも再吸収されなくなり、両方とも尿中に排泄されます。
輸送の仕組み:1個のグルコース+2個のナトリウムを同時に輸送
エネルギー源:ナトリウムの濃度勾配がグルコース輸送の原動力
SGLT2阻害の結果:ポンプが止まり、両方とも尿中へ排泄
心臓への効果
SGLT2阻害薬による穏やかなナトリウム利尿は、心臓の負担を軽減します。
ナトリウムが尿中に排泄されると、浸透圧の関係で水も一緒に引き出されます。
これにより循環血漿量が3-7%程度減少し、心臓が1回の拍動で送り出すべき血液量(前負荷)が軽減されます。同時に血圧も3-5mmHg程度低下するため、心臓が血液を送り出す際の抵抗(後負荷)も減ります。
重要なのは、この利尿作用がループ利尿薬(フロセミドなど)より穏やかで、低カリウム血症などの電解質異常を起こしにくいことです。心不全患者は利尿薬を長期使用することが多いため、この「穏やかさ」が臨床的に大きな意味を持ちます。
さらに興味深いのは、SGLT2阻害薬が心筋のエネルギー代謝にも影響を与える点です。
糖が尿中に排泄されることで、体は代わりに脂肪を分解してケトン体を産生します。このケトン体は、実はグルコースよりも酸素効率が良い燃料です。弱った心臓にとって、少ない酸素でより多くのエネルギーを得られることは大きなメリットとなります。
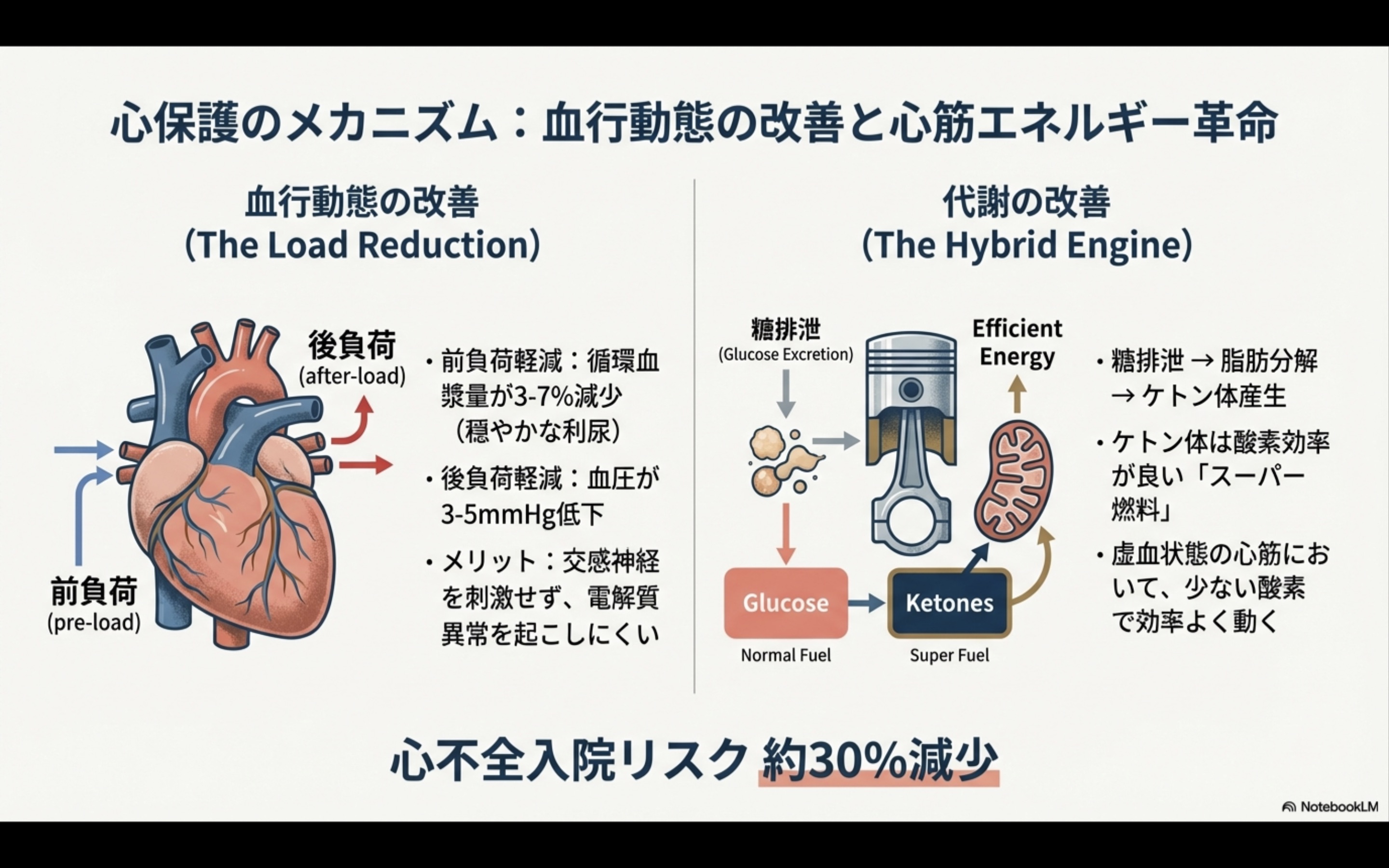
これらの効果が組み合わさることで、心不全入院リスクが約30%減少するという結果につながっています。
特に注目すべきは、左室駆出率が保たれた心不全(HFpEF)にも効果があることです。HFpEFはこれまで有効な治療法がほとんどなく、「治療の空白地帯」と呼ばれていました。SGLT2阻害薬はこの領域に初めて効果を示した薬剤クラスです。
腎臓への効果
腎臓への保護効果を理解するには、まず糖尿病が腎臓を傷つけるメカニズムを知る必要があります。
糖尿病患者の腎臓では「過剰濾過(hyperfiltration)」という現象が起こっています。
血糖が高いと、近位尿細管での糖とナトリウムの再吸収が増加します。すると、遠位尿細管に届くナトリウムが減り、腎臓は「ナトリウムが足りない」と誤認します。
この信号が糸球体に伝わり、濾過量を増やそうとして糸球体内圧が上昇します。これが長期間続くと、糸球体が疲弊して腎機能が低下していきます。
SGLT2阻害薬は、この悪循環を断ち切ります。
近位尿細管での糖・ナトリウム再吸収を阻害することで、遠位尿細管に届くナトリウムが正常化し、糸球体への「もっと濾過しろ」という誤った信号が止まります。
これを「尿細管糸球体フィードバックの正常化」と呼びます。
また、近位尿細管での糖再吸収にはエネルギーが必要です。
糖尿病患者では大量の糖を再吸収するために尿細管細胞が過剰に働き、酸素消費が増えて低酸素状態に陥ります。
SGLT2阻害薬で糖再吸収を減らすと、この酸素消費が減り、腎臓の低酸素状態が改善されます。
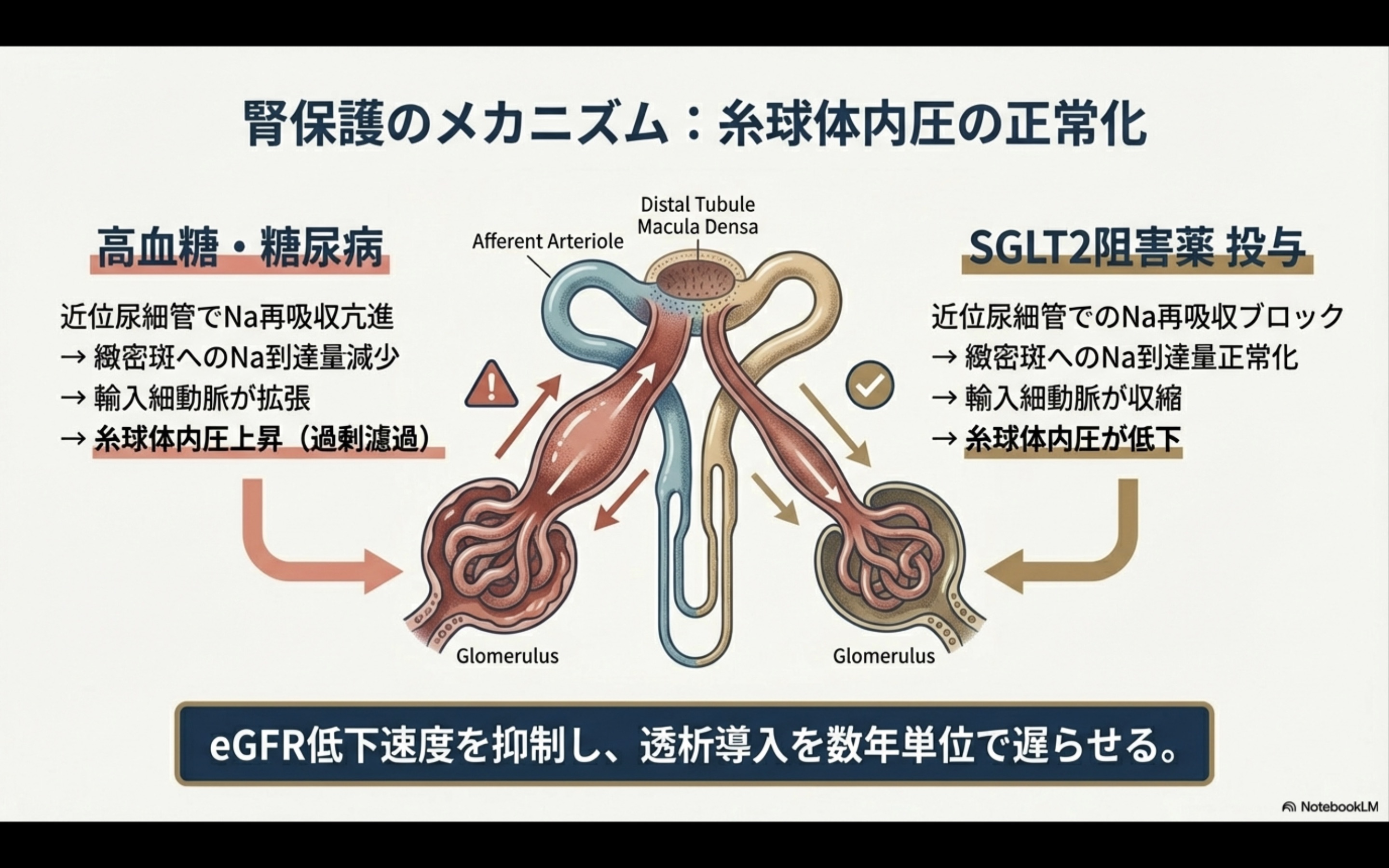
これらの効果により、糖尿病性腎症の進行を30-40%抑制できることが証明されています。重要なのは、eGFR 25(かなり腎機能が低下した状態)まで使用可能であり、透析導入を数年遅らせる可能性があることです。
全身性の保護効果
SGLT2阻害の効果は心臓・腎臓にとどまりません。
体全体の代謝状態に影響を及ぼします。
糖尿病や肥満の患者では、慢性的な軽度の炎症状態が続いています。
IL-6やTNF-αといった炎症性サイトカインが常に高く、これが血管内皮を傷つけ、動脈硬化を進行させます。
SGLT2阻害薬を使用すると、これらの炎症マーカーが低下することが観察されています。体重減少や血糖改善による二次的な効果もありますが、直接的な抗炎症作用も示唆されています。
興味深いのは、SGLT2阻害による軽度のカロリー喪失(1日約280kcal)が、カロリー制限と似た代謝変化を引き起こすことです。
カロリー制限が寿命延長に関わることは多くの研究で示されていますが、その背景にはAMPK(エネルギーセンサー)やSIRT1(長寿遺伝子)の活性化があります。
SGLT2阻害薬はこれらの経路を活性化することで、細胞レベルでの「若返り」効果をもたらす可能性があります。
また、エネルギー不足を感知した細胞はオートファジー(自食作用)を活性化し、古くなったタンパク質や損傷したミトコンドリアを分解・リサイクルします。
これは細胞の品質管理機構であり、その活性化は臓器保護につながります。
これらの効果がどこまで臨床的に重要かはまだ研究段階ですが、SGLT2阻害薬が単なる血糖降下薬を超えた多面的な作用を持つことを示しています。
クラスエフェクトまとめ
つまり:糖を捨てるために作った薬が、ナトリウムも捨てることで心臓と腎臓を守る薬になりました。
SGLT2阻害薬特有の副作用:正常血糖ケトアシドーシス(euDKA)
SGLT2阻害薬は多くの恩恵をもたらしますが、その独特な作用機序ゆえに医療従事者が必ず知っておくべき特有の副作用が存在します。
中でも最も重要なのが、正常血糖ケトアシドーシス(euDKA)です。
これはSGLT2阻害薬に特徴的な副作用であり、通常のケトアシドーシスとは異なる病態として、適切な理解と対処が求められます。
まずケトアシドーシスとは何か
糖尿病性ケトアシドーシス(DKA: Diabetic Ketoacidosis)
インスリンが極度に不足した時に起こる、糖尿病の急性合併症です。
通常の病態:
インスリン不足 → 細胞が糖を利用できない
代わりに脂肪を分解 → ケトン体(酸性物質)が大量産生
血液が酸性に傾く → アシドーシス(血液pH < 7.35)
典型的な特徴:高血糖(通常300mg/dL以上)+ケトーシス+アシドーシス
症状:悪心・嘔吐・腹痛、意識障害、Kussmaul呼吸(深く速い呼吸)
euDKAという特殊な病態
正常血糖ケトアシドーシス(euDKA: euglycemic DKA)とは、血糖値が比較的正常(200mg/dL未満)であるにもかかわらず、ケトアシドーシスが起こる状態を指します。
通常のDKAでは血糖値が300mg/dL以上に上昇するため、「血糖が高い=危険信号」として早期発見されやすいのですが、euDKAでは血糖値が正常範囲にとどまるため、発見が遅れやすいという危険性があります。
なぜSGLT2阻害薬でeuDKAが起こるのか
SGLT2阻害薬を服用していると、体は一種の「飢餓状態」に似た代謝変化を起こします。
まず、1日約280kcal相当の糖が尿中に排泄されることで、体はエネルギー不足を感知します。
血糖値が上がりにくいためインスリン分泌も抑えられ、結果としてグルカゴン優位の状態となります。
この状態では、肝臓での糖新生とケトン体産生が促進され、脂肪分解が亢進します。
通常であれば、この程度のケトン体産生は問題になりません。しかし、以下のような状況が重なると、ケトン体産生が制御不能となり、euDKAへと進展します。
高リスク状況(シックデイ)
極端な糖質制限:元々の糖質摂取が少ない+尿糖排泄
アルコール多飲:糖新生抑制+脱水
長時間の絶食:手術、検査、体調不良時
激しい運動:筋肉の糖消費+SGLT2阻害による喪失
感染症:ストレスホルモン上昇→インスリン拮抗
緊急対応:euDKAが疑われたら
euDKAが疑われた場合、まず行うべきはSGLT2阻害薬の即座の中止です。
そして、可能であれば糖質を摂取させます。経口摂取が困難な場合はブドウ糖の点滴を行います。
ここで重要なのが、血糖値が正常でもインスリン投与が必要という点です。
「血糖が正常なのになぜインスリンを?」と思われるかもしれませんが、euDKAの本質は血糖の問題ではなく、ケトン体の過剰産生にあります。
インスリンは脂肪分解を抑制する作用を持っており、これがないとケトン体の産生が止まりません。
血糖値だけを見てインスリンを控えると、ケトアシドーシスは進行し続け、致命的な結果を招きかねません。
また、ケトアシドーシスでは浸透圧利尿により脱水が進行しているため、輸液による水分補正も必須です。
同時に、インスリン投与に伴う低カリウム血症にも注意が必要で、電解質(特にカリウム)の補正も並行して行います。
さいごに
ダパグリフロジンの物語は、1835年のリンゴの樹皮から始まり、190年の時を経て「糖尿病薬」から「多臓器保護薬」へと進化しました。
「糖を尿に捨てる」という一見単純な作用機序の背景には、腎臓の精巧な糖再吸収システム、SGLT1とSGLT2の役割分担、そしてナトリウム利尿を介した心腎保護作用という、複雑で美しいメカニズムが存在します。
糖尿病なのに糖を出す、栄養を捨てる、という150年間誰も実用化できなかった発想が、今や糖尿病・心不全・慢性腎臓病という3大疾患に対応する薬へと変わりました。
SGLT2阻害薬を扱う際には、その多面的な効果を理解した上で、euDKAなどの特有の副作用にも注意を払いながら、患者さん一人ひとりに最適な治療を提供していきたいと思います。
この記事が何かしらのお役に立てば幸いです。